Prof. Ināra Logina: Polineiropātijas
Polineiropātijas (PN) ir perifēro nervu sistēmas slimību jeb perifēro neiropātiju grupa, kas vienlaikus skar daudzus somatiskos un autonomos nervus (1.attēls). Tā ir multietioloģiska patoloģija, ko raksturo patoģenētiski viendabīgs ģeneralizēts perifēro nervu šķiedru bojājums. Izšķir daudzas PN formas un veidus, kas ietekmē gan diagnostikas taktiku, gan terapijas iespējas.
Epidemioloģija
Nav daudz datu par PN izplatību vispārējā populācijā. Tie dažādos pētījumos ir arī visai atšķirīgi un variē atkarībā no etioloģiskā faktora, jo ir vairāk nekā 100 riska faktoru un slimību, kas var izraisīt perifēro nervu bojājumu. Metaanalīzes dati liecina - kopējā polineiropātiju izplatība iedzīvotāju vidū ir aptuveni 1%, bet gados vecākiem cilvēkiem tā pieaug līdz 7%. Ap 50% pacientu ar cukura diabētu attīstās PN, kas veido 18 līdz 49 % no to kopējā gadījumu skaita. PN novēro arī daudziem hroniskajiem alkoholiķiem – 13 līdz 66%, citi cēloņi ir ievērojami retāki.
Populācijas pētījumā Nīderlandē, Utrehtā konstatēta kopējā incidence 77.0/100 000 iedzīvotāju - gadā (95% CI 71.1-82.8) vecumā virs 18 gadiem. Biežākās diagnozes bija: diabētiskā polineiropātija (32% gadījumu), kriptogēna aksonāla neiropātija (26%), toksiskās (14%) un imūnās PN (9%).
Polineiropātiju patoģenēze
Tā var būt visai atšķirīga, atkarībā no izraisošajiem riska faktoriem, taču klīniskās izpausmes galvenokārt nosaka bojāto jeb iesaistīto nervu šķiedru veids un to funkcionālās īpatnības.
Somatiskos perifēros nervus veido funkcionāli atšķirīgas šķiedras (2. attēls): motorās – uz efektoriem jeb muskuļiem; sensorās - no ādas /gļotādām. Pēc impulsa vadīšanas virziena izšķir aferentās (uz CNS – muguras smadzenēm) un eferentās (no CNS). Arī veģetatīvās jeb autonomās nervu šķiedras vada gan aferentos, gan eferentos impulsus (uz un no iekšējiem orgāniem, dziedzeriem, asinsvadiem).
Pēc morfoloģiskā veida perifērās nervu šķiedras ir lielās (resnās) jeb mielinētās, ko sedz mielīna apvalks, un smalkās (sīkās) ar plānu mielīna apvalku (mazmielinētās) un bez mielīna apvalka seguma – nemielinētās. Impulsu vadīšanas ātrums pa motorajām mielinētajām šķiedrām var pārsniegt 100 m/s, turpretī smalko nemielinēto šķiedru ātrums ir ievērojami lēnāks – 0,5 līdz 2 m/s, lai gan arī tas ir pietiekams.
Aα šķiedras vada motoros eferentos impulsus, Aβ ir sensorās šķiedras, atbildīgas par propriocepciju, tausti, vibrācijas un kustības stāvokļa sajūtu. Abas pieder rupjo šķiedru grupai. Aσ un C šķiedras pieder pie smalkajām šķiedrām un ir atbildīgas par temperatūras uztveri un sāpēm. Arī autonomās ir smalkās C šķiedras (3.attēls). PN klīniskās izpausmes un pacientu sūdzības nosaka bojāto šķiedru veids.
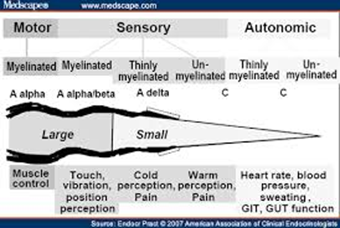
3. attēls. Perifēro nervu funkcionālais un morfoloģiskais iedalījums
Polineiropātiju klīniskie apakštipi.
To iedalījums jeb klasifikācija ir multidimensionāla.
Pēc klīniskajām izpausmēm – PN ir motoras, sensoras, autonomas un jauktas, korelē ar prevalējoši iesaistīto šķiedru bojājumu, mehānismu, etioloģiju, cēloni. Tas ietekmē terapijas metožu, tajā skaitā, medikamentu izvēli.
Pēc norises – akūtas (attīstība četru nedēļu laikā), subakūtas un hroniskas (attīstība ilgāk nekā astoņās nedēļās).
Pēc klīnisko simptomu lokalizācijas, iedala proksimālas, distālas, viscerālas un kraniālas neiropātijas, kas korelē ar patoģenētisko mehānismu. Ietekmē terapeitisko pieeju, galvenokārt rehabilitācijas aspektā.
Pēc patoģenētiskā mehānisma – var būt demielinizējošas (prevalējoši skarts nervu šķiedru mielīna apvalks), aksonālas (prevalējoši nerva aksona bojājums) un jauktas (4. attēls).
Praksē bieži lietots arī PN klīniski – morfoloģiskais iedalījums: smalko šķiedru neiropātija, lielo (rupjo) šķiedru neiropātija, autonomā neiropātija.
Lielo šķiedru neiropātijas tipiska izpausme ir distālas simetriskas sensori - motoras PN ar motoro un mielinēto sensoro Aβ šķiedru bojājums. Smalko šķiedru PN skar sensorās Aσ un C šķiedras, kā arī autonomās C šķiedras. Riska faktora ietekmē klīniski var pārklāties, pievienoties vai attīstīties vienlaicīgi abu veidu šķiedru slimība.
Terapijas taktikā būtisks ir PN etioloģiskais iedalījums: diabētiskās un citas endokrīnās (hipotireoze), toksiskās (alkohols, metāli, organiskās indes, medikamenti), metabolās - vitamīnu deficīta stāvokļi (malabsorbcija u.c.), citas sistēmiskās slimības (nieru, aknu, reimatiskās, kritiskā stāvokļa PN), infekcijas (Laima slimība, C hepatīts, HIV u.c.), imūnās neiropātijas (Gijēna-Barē sindroms un citi), limfoproliferatīvās slimības, vaskulārās slimības (vaskulīti, obliterējošās asinsvadu slimības), karcinomatozās (paraneoplastiskās), pārmantotās jeb hereditārās.
PN klīniskie simptomi
Rupjo šķiedru neiropātijas visbiežāk ir demielinizējošas, sensori motoras, akūtas un hroniskas, kas klīniski tipiski sākas ar kājām – pēdām.
Motorie traucējumi – tos nosaka motoro šķiedru bojājums, kas sākotnēji izpaužas kā cīpslu refleksu pazeminājums - arefleksija (Ahila cīpslas), distāla muskuļu hipotrofija (kājas kļūst distāli aizvien tievākas, iegūst tā saukto “apgāztas pudeles” formu, arī “stārķa kājas”, apavi kļūst vaļīgi – it kā par lielu) (5. attēls). Šie simptomi pacientu var netraucēt pat ilgstoši, īpaši hroniskas norises gadījumā, kā, piemēram, pārmantotās polineiropātijas. PN progresējot, pieaug perifērās parēzes klīniskās izpausmes ar distālu muskuļu spēka pazemināšanos jeb vājumu, kas jau var ievērojami ietekmēt funkcionālās spējas. Pēdu parēze nosaka tā saukto «stepāžas» gaitu, augstu ceļot krītošās pēdas (gaiļa gaita). Akūtas norises gadījumā vājums kājās var sākties arī proksimāli, skarot gan kājas, gan rokas, muskuļu atrofijas rodas vēlāk, nekā funkcionālais vājums.
Sensorie traucējumi rupjo šķiedru PN lielākoties sākas ar pēdām un jušanas traucējumi attīstās distāli pēc «cimdu- zeķu» tipa. Prevalē negatīvie sensorie simptomi – vibrācijas, taktīlās (pieskāriena), proprioceptīvās sajūtas pazeminājums un zudums, kas subjektīvi traucē kā notirpums, nejūtīgums. Izteikts rupjo šķiedru bojājums var ietekmēt arī kustību funkciju sensitīvas ataksijas veidā - propriocepijas zuduma dēļ nestabila gaita (nejūt zemi zem kājām, jāskatās, kur liek kājas, īpaši tumsā, gaita būtiski uzlabojas redzes kontrolē).
Tādējādi lielo (rupjo) šķiedru bojājums var netraucēt, pacientam ilgstoši var nebūt sūdzību – asimptomātiska, subklīniska norise, taču, gan akūtas, gan hroniskas norises gadījumos var radīt dziļu invaliditāti.
Smalko šķiedru neiropātijas ir aksonālas, sensoras un autonomas, visbiežāk hroniskas, ievērojami retāk akūtas.
Sensorie traucējumi – sākotnēji tipiski – distāli simetriski pēdās, izplatās uz augšu - proksimāli kājās, un traucējumi rokās rodas daudz vēlāk. Galvenās izpausmes ir neiropātiskās sāpes un to fenomeni.
Raksturīgi spontāni sensori traucējumi: dedzināšana (dizestēzijas), dziļas sāpes, paroksizmālas (neiralģiskas) sāpes, salšana (parestēzijas), arī neiropātiska nieze. Tipiskas ir provocētas sāpes: allodīnija (parasts, normāls nesāpīgs kairinājums ir nepatīkams, sāpīgs), īpaši termiska un biežāk siltum aizraisīta, arī dinamiskā mehāniskā allodīnija (nepatīkams pieskāriens, novilkšana ar mīkstu otiņu, vatīti). Provocētie simptomi ir arī hiperalgēzija (pastiprināti sāpīgs un nepatīkams, jau sāpīgs kairinājums) un hiperpātija (pastiprināta sajūta pēc kairinājuma). Novēro arī negatīvos simptomus – termohipestēziju, hipoalgēziju.
Autonomie (veģetatīvie) simptomi izpaužas distāli locekļos – ādas inervācijas izmaiņas un kā viscerālo orgānu funkciju traucējumi.
Autonomie (veģetatīvie) ādas inervācijas traucējumi ir sviedru izdalīšanās (pārlieku sausa vai mikla āda), ādas krāsas izmaiņas, mikrocirkulācijas traucējumi, sarkanas, “degošas” pēdas (eritromelalģija), čūlas pēdās.
Autonomā viscerālā neiropātija rada sirds darbības izmaiņas (miera tahikardija, aritmija), posturālā spiediena izmaiņas (ortostātiskā hipotenzija, ģīboņi), viscerālo sāpju zudums (bezsāpju miokarda infarkti), izmainīta ģeneralizētā svīšana (pastiprināta vai anhidroze), gastroparēze, impotence, patoloģiska ejakulācija, seksuāla disfunkcija sievietēm.
Autonomos simptomus var iedalīt holīnerģiskos (sausas acis, neskaidra redze (III n) sausa mute (IX n), impotence, aizcietējumi, sviedru izdalīšanās traucējumi) un adrenerģiskos (ortostātiska hipotenzija, fiksēts pulss, ejakulācijas traucējumi, ādas mikrocirkulācijas traucējumi).
Nereti novēro jauktas PN – lielo un smalko neiropātiju simptomu pārklāšanās, aksonāls un demielinizējošs nervu šķiedru bojājums vienlaikus.
Polineiropātiju diagnoze
Pieejami vairāku diagnostisko un terapeitisko vadlīniju ieteikumi un algoritmi, biežāk specifiskām neiropātijām – diabētiskajai, smalko šķiedru, hereditārajām. Ir arī atsevišķu valstu vadlīnijas, piemēram, Nīderlandes, Zviedrijas, kas pieejamas nacionālajā valodā. Kopumā diagnostisko pasākumu ieteikumi ir samērā līdzīgi.
Distālas simetriskas polineiropātijas (DSP) precīzu klīnisko diagnozi nosaka neiropātisko simptomu jeb sūdzību, pazīmju un elektrodiagnostisko izmaiņu kombinācija.
Klīniskie simptomi (sūdzības) sākotnēji sensori vai/un motori: tipiskie sensorie – tirpšana, dedzināšana, durstošas parestēzijas, dizestēzijas, alodīnija distāli, locekļu vājums jeb nespēks, kas sākas ar pēdām simetriski – abās pusēs, lai gan sākotnēji iespējama asimetrija. Vienīgi simptomi (subjektīvās sajūtas jeb sūdzības) ir nepietiekami kritēriji PN diagnozei, klīniskās pazīmes (refleksi, atrofija, pēdu forma, spēks, jušanas zudums, alodīnija un citi) ir ar lielāku diagnostisko vērtību (konstatē neiroloģiskā izmeklēšanā). Turklāt atsevišķu rādītāju izmaiņas ir mazāk sensitīvas nekā multiplas.
Neirogrāfija jeb nerva vadīšanas izmeklējums ir elektrofizioloģiska izmeklēšanas metode, ar kuru nosaka vadīšanas ātrumu pa motorajām un sensorajām nervu šķiedrām, motoro un sensoro impulsu latences un potenciālu amplitūdas. Demielinizējošām neiropātijām raksturīgs ievērojami palēnināts vadīšanas ātrums pa motorajām un/ vai sensorajām šķiedrām, pagarinātas distālās latences, var būt segmentāls nerva vadīšanas bloks vai patoloģiska temporāla dispersija. Savukārt aksonālo neiropātiju gadījumā ir samazināts motoro un sensoro šķiedru darbības potenciāls
Šī elektrofizioloģiskā metode nosaka nervu vadīšanu pa rupjajām šķiedrām Aα, Aβ un to atzīst par visnoderīgāko metodi perifēro neiropātiju novērtēšanai un dokumentēšanai, lai nav nodrošināta informācija par smalko šķiedru funkcijām. Diagnozes noteikšanai jāizmeklē vismaz trīs sensorie un četri motorie nervi.
Pastāv arī ieteikumi PN diagnozes noteikšanai, pamatojoties tikai uz klīniskās izmeklēšanas atradni bez papildus jeb aparātu izmeklējumiem. Piemēram, diabētiskas PN klīniskā diagnoze var būt noteikta, ja pozitīvi ir divi no trim šādiem kritērijiem: 1.neiropātiskas sāpes 10 mm VAS jeb kā viena balle pēc NRS, parestēzijas, nejūtīgums jeb notirpums (smalko sensoro A, C šķiedru funkcija);
2. cīpslu refleksu zudums (rupjo motoro A šķiedru funkcija); 3.izmainīta vibrācijas sajūta uz potītes (rupjo sensoro Aβ šķiedru funkcija).
Smalko šķiedru polineiropātijas
Arī smalko šķiedru PN diagnoze balstās uz klīniskajiem simptomiem ar prevalējoši neiropātisku sāpju un to ekvivalentu fenomeniem, kombinējot tos ar papildus izmeklējumiem.
Viens no piedāvātajiem algoritmiem (6. attēls), kas ieteikts diabētiskās PN diagnozes noteikšanai, bet pielietojams arī citos gadījumos, ir šāds: iespējama PN diagnoze – distāli simptomi (sūdzības) un/vai klīniskās pazīmes (temperatūras un sāpju sajūtas pazeminājums un/vai alodīnija/hiperalgēzija). Varbūtēja PN - distāli smalko šķiedru bojājuma simptomi, klīniskās pazīmes + nav nervu vadīšanas izmaiņu (normāla neirogrāfija). Noteikta PN diagnoze – smalko šķiedru bojājuma simptomi distāli, klīniskās pazīmes + normāla NG + samazināts intradermālo nervu šķiedru blīvums potītes apvidū un/vai izmaiņas kvantitatīvās sensorās testēšanas izmeklējumā - KST (QST).
Vēl kādā citā avotā norādīts, ka smalko šķiedru neiropātijas diagnozi apstiprina izmaiņas vismaz divos no trim izmeklējumiem: 1. klīniskās pazīmes; 2. kvantitatīvā sensorā testēšana (KST jeb QST); 3. ādas biopsija. Turklāt ādas biopsijai ir lielākā diagnostiskā vērtība – izmaiņas atrod 88.4% gadījumu, klīniskajā izmeklēšanā – 54,6% un KST – 46,9%. Sāpju un termālo hipalgēziju atrod 50% pacientu, perifēro vaskulāro autonomo disfunkciju – 70%.
Kvantitatīvā sensorā testēšana (KST) ir funkcionāla izmeklēšanas metode, ar kuru mēra sajūtas uztveres slieksni – percepcija un sāpju slieksnis precīzi kalibrētam sensorajam stimulam - vibrācijām, termo, sāpju kairinātājam. Novirzes no normas norāda uz traucējumu jebkurā sensoro ceļu posmā.
Modificēta kvantitatīvās sensorās testēšanas metode ir neirometrija, ar kuru automatizēti selektīvi novērtē trīs atšķirīgo sensoro šķiedru grupu uztveres slieksni. Kā sensoro šķiedru kairinātāju izmanto elektrisko strāvu, bet tādējādi netiek diferencētas modalitātes.
Ādas biopsijai ir lielākā diagnostiskā vērtība. Tiek veikta ādas punkcijas biopsija (punch) ar trīs milimetru diametra adatu piecus centimetrus virs laterālās potītes. Ar imūnhistoķīmisku metodi, lietojot antivielas pret proteīna gēna produktu 9,5 (ubikvitīna neironālā forma), iekrāso un nosaka intradermālo nervu šķiedru skaitu / blīvumu, kas būtiski samazināts neiropātijas gadījumā.
Autonomā disfunkcija raksturīga smalko šķiedru polineiropātijas pacientiem (70% pacientu). Ir daudz dažādu testu, taču vairums nav pietiekami standartizētas un validētas metodes, tomēr daudzas ar samērā augstu pierādījuma līmeni. Eksistē atšķirīgas tehnoloģijas un aparatūras. Vadošās metodes autonomas neiropātijas diagnostikā ir kardiālie un asinsrites regulācijas (adrenerģiskie) testi, sudomotorie (postganglionārie) un vazomotorie testi locekļos.
Simpātiskās ādas atbildes reakcijas noteikšana (SĀAR) – sudomotorais tests reģistrē pārmaiņas ādas elektriskajos potenciālos pēc stimulācijas, ko nosaka refleksa loks: eferentās sudomotorās simpātiskās šķiedras aktivē sviedru dziedzerus ādā un izdalās sviedri. Nosaka pārvades ātrumu pa simpātiskajām nervu šķiedrām, to amplitūdu, latences, kas C šķiedru bojājuma gadījumos ir izmainītas.
R-R intervāla jeb sirds darbības frekvences svārstību reģistrācijai izmanto NG un EMG aparatūru, «slīpā galda» datorizētu sistēmu. R-R svārstības veselam cilvēkam, dziļi elpojot, samazinās vismaz par 15%, patoloģijas gadījumā R-R intervāla svārstības ir mazākas. Valsalvas testā veic izelpu ar pretestību aptuveni 40 mmHg 15 sekundes, mēra proporciju starp garāko R-R īsi pēc testa pret īsāko R-R testa laikā.
PN laboratoriskā izmeklēšanā nepieciešamie izmeklējumi ir asins aina, elektrolīti, nieru, aknu rādītāji, cukurs un glikozētais hemoglobīns, imūnelektroforēze (paraproteīni). Paplašinātu laboratorisko izmeklēšanu veic pēc nepieciešamības un PN etioloģijas diferenciāldiagnozei. Tipiski, ja anamnēze neatklāj sistēmiskas slimības pazīmes, arī laboratoriskie izmeklējumi lielākoties ir negatīvi.
Polineiropātiju veidi pēc to etioloģijas
Diabētiskā perifērā neiropātija. Tās attīstību nosaka vairāki patoģenētiskie mehānismi. Tiešu metabolu ietekmi uz nervu šūnām un to apvalkiem izdara hiperglikēmija un poliola utilizēšana, oksidatīvais stress, arī neirotropie faktori, gēnu ekspresija, omentīna (protektīva adipokīna) samazināšanās 2.tipa diabēta pacientiem ar PN. Arī diabētiskā mikroangiopātija izraisa nervu išēmiju un nervu šķiedru bojājumu. 47% diabēta pacientu ir kāda perifēras neiropātijas forma, vairāk nekā pusei no viņiem tā ir distāli simetriska. Fokāla neiropātija (karpālā kanāla sindroms) konstatēta 14 līdz 30%, pārējiem – radikulopātijas /pleksopātijas un kraniālās neiropātijas. Neiropātija konstatēta 7,5% pacientu jau diabēta diagnozes noteikšanas brīdī. II tipa cukura diabēta pacientiem neiropātija veidojas ātrāk un biežāk. Diabētiskās PN specifiskā terapija balstās adekvātā diabēta aprūpes taktikā – riska faktoru korekcija, dzīves stila izmaiņas, ieskaitot fizioterapiju, adekvāta glikozes korekcija, diabētiskās pēdas profilakse un aprūpe. Simptomu specifiska terapija – neiropātisko sāpju, autonomo traucējumu, citu līdzīgu PN formu simptomu terapija.
Alkohola izraisīta polineiropātija. 22 līdz 66% hroniskiem alkohola lietotājiem attīstās aksonāla sensori motora un arī autonoma PN, lietojot >100 gramiem alkohola dienā vairākus gadus. Biežāk, nepārtraukti lietojot, un arī sievietēm. Tās patoģenēze saistīta ar malnutrīciju, īpaši B vitamīnu uzsūkšanās traucējumiem, ar alkohola un tā degradācijas produktu (acetilaldehīdu) tiešu toksisku ietekmi uz nervu šķiedrām, oksidatīvo stresu, aknu funkciju traucējumiem. Specifiska terapija paredz alkohola lietošanas pārtraukšanas un diētas modifikācijas malnutrīcijas korekcijai. Pārtraucot alkohola lietošanu, atgriezeniska attīstība iespējama mēnešu vai dažu gadu laikā.
Ķīmijterapijas inducēta toksiska neiropātija. To izraisa daudzi citostātiski līdzekļi – platina derivāti, taksāni, vinca alkoloīdi, proteosomu inhbitori, monoklonālo antivielu preparāti. Palielinās PN skaits, jo pieaug audzēju pacientu skaits un pagarinās viņu dzīvildze. Pēc ķīmijterapijas to novēro 10% līdz 90 % vai 30% līdz 40% pacientiem. Tipiski sākas ar sensoriem traucējumiem pirmajos divos mēnešos pēc terapijas uzsākšanas, - 40% novēro neiropātiskas sāpes. Pārtraucot terapiju, PN simptomi stabilizējas vai pat izzūd. Akūti neirotoksiski simptomi pēc oksiplastīna ir atgriezeniski 60 līdz 80% pacientu. Imunomodulējošo antivielu pielietošana audzēju ķimijterapijā var izraisīt akūtas vai hroniskas imūnās neiropātijas, kuru terapijā pielieto specifisku imūnmodulējošu terapiju.
Citas toksiskas polineiropātijas. Zināmi daudzi eksogēni toksīni un metāli, kas izraisa PN – arsēns, svins, dzīvsudrabs, tālijs, šķīdinātāji, akrilamīds oglekļa disulfīts. Īpaši jāmin daudzi medikamenti, ko ilgstoši lietojot un kombinācijā ar citiem riska faktoriem, var bojāt perifēro nervu šķiedras – tie ir pretmikrobu līdzekļi (hlorokvīns, dapsons, kolhicīns, zelta preparāti, talidomīds, metronidazols, nitrofurantoīns, izoniazīds, kvinoloni), imunosupresanti (tacrolimus), kardiovaskulārie līdzekļi (amidarions, dronedarons, hidralazīns, propafenons), psihoterapeitiskie līdzekļi (disulfirāms, lītijs), citi medikamenti (piridoksīns jeb B6 vitamīns, fenitoīns). Specifiski terapeitiski pasākumi ir izvairīšanās no to iedarbības un toksīnu izvadīšana, saindēšanās gadījumos ar smagajiem metāliem – forsēta diurēze un kompleksonu lietošana to saistīšanai.
Vitamīnu deficīts un pārdozēšana. Zināma ir B12 deficīta izraisīta rupjo šķiedru neiropātija un arī muguras smadzeņu mugurējo stabu bojājuma sindroma attīstība – funikulārā mieloze, kas lielākoties saistīt ar citām B12 deficīta pazīmēm, tajā skaitā makrocitārā anēmija. B6 vitamīna deficīts un arī pārdozēšana var izraisīt sensori motoru polineiropātiju. B1 vitamīna deficīts arī ir saistīts ar PN veidošanos. Patoģenētiski šīs PN saistās ar uzsūkšanās traucējumiem kuņģa zarnu traktā. Specifiskā terapija pamatā ir aizvietojoša, vitamīnu terapija uzsūkšanās traucējumu gadījumā lielākoties arī ir parenterāla. Svarīgi koriģēt malnutrīcijas iemeslu.
Imūnmediētas perifērās neiropātijas. Klīniski neviendabīga polineiropātiju grupa, kas saistīta ar imūniem mehānismiem - B-limfocītu aktivitāte un antivielu veidošanās pret nervu šūnām un mielīna apvalkiem; T-limfocītu mediētā un celulārā imūno atbilde ar 4. tipa autoalerģisko reakciju; makrofāgu iesaistīšanās, fagocitoze un imūns iekaisums. Šo reakciju var ierosināt infekciozie aģenti – kampilobaktērija, herpētiskie vīrusi. Pieder pie retajām slimībām: 0,6 līdz trīs gadījumi uz 100 000 populācijas gadā, atsevišķas formas vēl retāk. Daudzas no tām ir invalidizējošas un dažas pat dzīvību apdraudošas, izraisot akūtas paralīzes, bulbāru sindromu ar rīšanas traucējumiem, elpošanas paralīzi, kā piemēram, akūts postinfekciozs poliradikuloneirīts jeb Guillain-Barre sindroms (GBS) vai Miller-Fisher sindroms, taču vairums noris hroniski – kā hroniska iekaisīgā PN, hroniska motorā neiropātija, multifokāla iegūta demielinizējoša sensora un motora neiropātija, multifokālā motorā neiropātija ar vadīšanas bloku, paraproteinēmiskās demielinizējošās neiropātijas. Imūnās neiropātijas var būt gan motoras, gan sensoras, gan demielinizējošas, gan arī aksonālas. Galvenā šo neiropātiju ārstēšanas metode ir savlaicīgi agrīni uzsākta imūnterapija – intravenozie imūngloglobulīni, arī subkutānie, plazmas apmaiņa, kortikosteroīdi, imūnsupresanti, moniklonālo antivielu preparāti, piemēram, rituksimabs. Izvēle atkarīga no PN veida, klīniskās norises un gaitas.
Infekciozas akūtas polineiropātijas. Tiešas infekciozo aģentu iedarbības izraisītās neiropātijas ir diferencējamas ar imūnmediētajām neiropātijām. Difterija var izsaukt GBS līdzīgu norisi, reizēm tādu izraisa arī sifiliss. Turpretī Laimas neiroboreliozei, arī C hepatītam raksturīga sensorā sāpošā smalko šķiedru neiropātija. Tipisku perifērās nervu sistēmas sensoro šķiedru bojājumu izraisa lepra. Cilvēka imūndeficīta vīrusa infekcijai, īpaši AIDS stadijā, raksturīgas vairākas polineiropātiju formas - gan vīrusa tiešas iedarbības rezultātā, gan vaskulīta vai medikamentu toksiskas iedarbības izraisītas. Svarīgi pierādīt sakarību ar izraisošo infekciju, kas ne vienmēr ir viegli, un pielietot atbilstošu terapiju.
Hereditārās jeb pārmantotās polineiropātijas. Liela ģenētisko slimību grupa ar prevalenci 1:2500. Daudzi iepriekš nezināmi gēni un to defekti identificēti ar mūsdienīgām gēnu sekvencēšanas metodēm – šobrīd konstatēti vairāk nekā 100. Zināms gan autosomāli dominants, gan autosomāli recesīvs un ar X-hromosomu saistīts pārmantošanas tips, arī mitohondropātijas. Izdala četras galvenās to apakšgrupas: pārmantotās motori sensorās neiropātijas, pārmantotās sensorās neiropātijas, pārmantotās motorās neiropātijas un pārmantotās sensori autonomās neiropātijas. Biežākā pārmantoto neiropātiju forma ir Šarko – Marī neiropātijas (Charcot – Marie – Tooth jeb CMT), kas ir ģenētiski heterogēna pārmantota perifērās nervu sistēmas slimība un, ko nosaka daudzi desmiti gēnu, bet vairāk nekā pusē gadījumu tā ir 17.hromosomas PMP22 gēna duplikācija – CMT 1A tips, un to diagnosticēt iespējams arī Latvijā. CMT slimības klīniskais fenotips, neraugoties uz vairākiem ģenētiski molekulārajiem apakštipiem, ir relatīvi homogēns jeb viendabīgs: progresējošs distālo muskuļu vājums un atrofijas, pēdu deformācijas, distāli jušanas traucējumi. Vēl ir arī grupa pārmantoto neiropātiju ar noteiktu metabolu defektu jeb polineiropātijas citas ģenētiski determinētas slimības ietvaros – porfīrija, Refsuma slimība, Fabri slimība, ģimenes amiloidoze. Nav standartizētas pārmantoto PN terapijas, tā ir simptomātiska un atbalstoša. Reizēm nepieciešama ortopēdiska palīdzība pēdas un skeleta deformāciju korekcijai, arī ortozes un palīglīdzekļi.
Citu sistēmisku slimību izraisītas polineiropātijas. Bez jau iepriekš minētajām, ir vēl daudzas citas sistēmiskas slimības, kas var ietekmēt perifēro nervu šķiedru patoloģiju ar atbilstošu patoģēnētisku mehānismu. Hroniska nieru slimība un urēmija tipiski izraisa smalko šķiedru neiropātiju. PN ir viens no tipiskiem sindromiem un pat diagnostiskiem kritērijiem sistēmisko vaskulītu gadījumos - nodozais poliarterīts, garnulomatozais poliangiīts. Tās ir raksturīgas arī citām sistēmiskām saistaudu slimībām - Sjogrēna sindromam, sarkanai vilkēdei, arī sarkoidozei. Celiakija un iekaisīgās zarnu slimības, piemēram, Krona slimība, uzsūkšanās traucējumu rezultātā var manifestēt gan ar autonomu viscerālu, gan sensoru smalko šķiedru neiropātiju ar neiropātisko sāpju sindromu. Disglobulinēmiju izraisītās PN (krioglobulinēmija, mielomas slimība, makroglobulinēmija) un paraneoplastiskas PN patoģenētiski ir saistītas ar imūniem mehānismiem. Savukārt kritiskā stāvokļa neiropātijas attīstās pēc ilgstošas ārstēšanas reanimācijā vai parenterālās barošanas. Specifiska šīs grupas PN terapija ir izraisošās pamatslimības atbilstošas korekcijas.
Polineiropātiju terapija
Specifiskā terapija minēta iepriekš, skaidrojot polineiropātiju iedalījuma pēc to etioloģijas, ņemot vērā iespējas ietekmēt PN patoģenēzi, piemēram,- imūnterapija imūnmediēto neiropātiju ārstēšanā; vitamīnu deficīta, cukura diabēta korekcija u.c.
Nespecifisku terapiju nozīmē, neatkarīgi no perifērās neiropātijas simptomātiskas un patoģenētiskas etioloģijas. Daudziem praksē plaši lietotiem medikamentiem un metodēm nav pietiekami augsta līmeņa iedarbības pierādījumu.
Neiropātisko sāpju terapija – aptuveni 50% PN pacientu ir neiropātiskas sāpes, kuru mazināšanai izmanto vairākas līdzekļu grupas, ko iesaka daudzās vadlīnijās. Pretepileptiskie līdzekļi atbilstošās devās un atbilstošā režīmā – gabapentīns (1200 - 3600 mg/dn trīs reizēs), pregabalīns (300-600 mg/ dn divās reizēs), karbamazepīns, fenitoīns, tricikliskie antidepresanti – amitriptilīns, nortriptilīns, klomipramīns vienā vai divās reizēs līdz 25-125 mg/dn. SNRI antidepresanti – duloksetīns 60 līdz 120 mg/dn, venlafaksīns 150 līdz 225 mg/dn. Minētie ir pirmās izvēles līdzekļi, un svarīgi uzsvērt adekvātu devu lietošanu, jo ikdienas praksē tos nereti nozīmē suboptimālās devās, kas nevar nodrošināt pietiekamu pretsāpju efektu.
Otrās izvēles preparāti ir narkotiskie pretsāpju līdzekļi - tramadols, morfijs, kodeīns, ko titrē individuālās devās. Atsevišķos gadījumos efektīvi ir topikālie līdzekļi - kapsacaīns, lidokaīns, dimeksīds (dimetilsulfoksīds). Minēts arī mentols, sinepju eļļa, piparmētru eļļa, kampars. Atsevišķos gadījumos izmanto arī botulīna toksīna injekcijas, NMDA receptoru blokatorus – dekstrametorfānu, deksmedetomidīnu un ketamīnu.
Autonomās neiropātijas terapija ietver ortostātiskā hipotenzijas korekciju (fludrikortizons, midodrīns); erektīlās disfunkcijas mazināšanu (sildenafils); gastroparēzes ietekmēšanu (metaklopramīds, cisaprids).
PN pacientiem simptomu un funkcionāla deficīta ietekmēšanai – stabilitātes, gaitas, muskuļu spēka, funkcionālo spēju uzlabošanai, stabilizācijai vai noturēšanai, arī deformāciju un kontraktūru profilaksei nepieciešama fizioterapija, ergoterapija un vingrinājumi. Ieteicama arī fizikālā un balneoloģiskā terapija, īpaši pēdu aprūpe, bet ne tikai diabēta pacientiem. Ja traucēta rokas funkcija, svarīga atbilstoša ergoterapija. Pacientiem ar izteiktiem motoro funkciju traucējumiem būtiska ir atbilstošu palīglīdzekļu lietošana.
Patoģenētiskā terapija ar mērķi uzlabot mielīna un aksonu metabolismu - daļa ieteikumu ir bez pietiekamiem pierādījumiem. α-liponskābes preparātus iesaka un izmanto diabētiskās polineiropātijas terapijā, bet lieto arī daudzos citos gadījumos kā off-label jeb, – ārpus etiķetes. Diabētiskās perifērās neiropātijas patoģenētiskajai terapijā ir pētījumi un pierādījumi arī par tiamīnu jeb B1 vitamīnu lielās devās (50 līdz 300 mg/dn). Nereti nozīmē arī mikrocirkulāciju uzlabojošos līdzekļus un antioksidantus, bet tam nav pietiekami pierādījumu. Praksē bieži izmanto antiholīnesterāzes preparātus, īpaši motorajā polineiropātijā, kas balstās uz klīniskās prakses pieredzi, taču šajā jomā nav pētījumu ar pārliecinošiem pierādījumiem. Nozīmējot šos līdzekļus, nedrīkst aizmirst par to holīnerģiskajiem efektiem un kontrindikācijām: epilepsija, ekstrapiramidāli traucējumi ar hiperkinēzi, stenokardija, izteikta bradikardija, bronhiālā astma, zarnu vai urīnceļu nosprostojums, kuņģa čūlas vai divpadsmitpirkstu zarnas čūlas paasinājums, vestibulāri traucējumi, grūtniecība, barošana ar krūti (www.zva.gov.lv).
Savlaicīga un adekvāta polineiropātija un tās cēloņa diagnostika ir priekšnoteikums atbilstošas specifiskas ārstēšanas uzsākšanai. Ja tā nav iespējama, tikpat svarīga ir stāvokļa stabilizācija, simptomu korekcija un pacienta dzīves kvalitātes uzlabošana.
Foto: Shutterstock
Rakstu lasiet arī „Ārsts.lv” 2022. gada maija numurā!
Portālā "Ārsts.lv" publicēto rakstu pārpublicēšana iespējama tikai, saskaņojot ar portāla redakciju!


