Ilze Aizsilniece, Arta Deniņa: Imūnās sistēmas, mikrobioma un uztura loma autoimūno slimību izcelsmē
Lai cilvēks varētu dzīvot, ir nepieciešams ne tikai tas, lai visi orgāni funkcionētu pareizi un efektīvi, bet arī lai smalkas regulācijas ietvarā darbotos imūnā sistēma. Imūnās sistēmas galvenais mērķis ir nodrošināt organisma aizsardzību pret patogēniem – baktērijām, vīrusiem, sēnītēm, toksīniem –, kā arī audzējiem. Var teikt, ka imūnā sistēma ir sarežģīta dažādu šūnu, to “ražoto” bioloģiski aktīvo vielu un apkārtējās vides faktoru kompleksa mijiedarbības mašinērija, kuras precīzs darbības mehānisms nav pilnībā izzināts – imunoloģija kā zinātne, kas pēta tieši imūno sistēmu un tās darbību, ir viena no jaunākajām medicīnas apakšnozarēm. Jo īpaši tas attiecas uz gadījumiem, kad ir zaudēta šī smalkā regulācija un tāpēc sākas autoimūnas slimības, kad organisma imūnā sistēma darbojas nevis aizsargājoši, bet tieši pretēji – uzbrūkoši un iznīcina paša organisma audus.
Imūno sistēmu veido dažādas šūnu populācijas, piemēram, antigēnprezentētājšūnas (makrofāgi, dendrītiskās šūnas), limfocīti (dabiskās galētājšūnas jeb angliski – natural killer cells, B un T limfocīti), neitrofilie leikocīti, monocīti. Šoreiz galveno uzmanību pievērsīsim T limfocītiem, kuriem ir liela nozīme gan organisma aizsardzībā pret patogēniem, gan arī saskaņā ar jaunākajiem pētījumiem imunoloģijā – autoimūnu procesu izcelsmē, kad imūnsistēmas šūnas sāk vērsties pret paša organisma proteīniem, tos iznīcinot.
Īpašu interesi raisa limfocīti CD4+ – T līdzētājšūnas (angliski T helper cells) un to apakštipi jeb fenotipi. Ir izpētīts, ka 17. fenotipam jeb Th 17 ir būtiska loma daudzu autoimūnu slimību – iekaisīgu zarnu slimības, psoriāzes, multiplās sklerozes, reimatoīdā artrīta, juvenilā reimatoīdā artrīta, Šēgrēna sindroma, 1. tipa cukura diabēta, autoimūnu vairogdziedzera slimību un myasthenia gravis (miastēnija – slimība, kuras nozīmīgākā izpausme ir progresējošs muskuļu vājums) – attīstībā.
T limfocīti nobriest aizkrūts dziedzerī (thymus), un atkarībā no to virsmas proteīniem un funkcijas tiek iedalīti T līdzētājšūnās (CD4+) un šūnu bojājumus izraisošajās jeb citotoksiskajās efektoršūnās (CD8+). CD šo šūnu nosaukumos ir saīsinājums no angļu valodas apzīmējuma cluster of differentiation – diferenciācijas klasteri jeb speciāli virsmas proteīni. Šie proteīni ir iesaistīti šūnu savstarpējā signālsistēmā un ļauj fenotipiski atšķirt dažādus leikocītus. Ja šūnai uz virsmas atrodas šāds proteīns, tad to apzīmē ar +. Pētījumi rāda, ka jau pieminētās 17. fenotipa šūnas jeb Th 17 ir iesaistītas lielākās daļas autoimūno slimību attīstības procesā. Iemesls, pirmkārt, ir iekaisums, visbiežāk zarnās un, otrkārt, šo šūnu augstais plastiskums jeb spēja pārveidoties un noteiktos apstākļos kļūt īpaši patogēnām.
T līdzētājšūnas ražo citokīnus – bioķīmiski aktīvas imūnās sistēmas savstarpējās saziņas proteīnu molekulas, ko imūnās sistēmas šūnas ražo, lai iedarbotos uz citām imūnšūnām. Šie citokīni aktivē vai modulē iedzimtās imūnās sistēmas šūnas (makrofāgus, dendrītiskās šūnas, dabiskās galētājšūnas) un arī epitēlijšūnas. T limfocītus no citām šūnām atšķir specifiski proteīni – T šūnu receptori, kas, sasaistoties ar specifisku molekulu antigēnu, izraisa T limfocītu aktivāciju, jaunu limfocītu attīstību un diferenciāciju noteiktos fenotipos ar atšķirīgu transkripcijas faktoru izstrādāšanos, citokīnu izdalīšanos un imunoloģisko funkciju. Transkripcijas faktori ir specifiski proteīni, kas darbojas kā gēnu slēdži un spēj “ieslēgt” vai, tieši pretēji, “neiedarbināt” noteiktu gēnu. No gēnu “ieslēgšanas” (ekspresijas) savukārt atkarīga proteīnu sintēze, kas smalkas molekulārās regulācijas ceļā vai nu sekmē saslimšanu un slimības attīstību, vai palīdz uzturēt veselību un ļauj izveseļoties.
Noteiktu citokīnu ietekmē T līdzētājšūnas spēj mainīt savu fenotipu un funkcijas, kā arī iegūt īpašības, kas raksturīgas citam T līdzētājšūnu fenotipam. Šeit īpaša nozīme ir transkripcijas faktoru aktivētajiem molekulārajiem mehānismiem. Tie spēj aktivēt pat tādus gēnus, kuri nebija raksturīgi sākotnējam T līdzētājšūnu fenotipam. Tā tas notiek, piemēram, ja iesaistās iekaisumu sekmējošais interleikīns-23 (IL-23), kuru izstrādā dendrītiskās šūnas, makrofāgi. Interleikīns-23 sekmē T līdzētājšūnu diferenciāciju par 17. fenotipu, ar kuru saista autoimunitātes veidošanos.
Lielākā daļa cilvēka imūnās sistēmas atrodas gremošanas traktā, tāpēc uzturam ir būtiska nozīme homeostāzes jeb organisma iekšējās vides līdzsvara un fizioloģisko funkciju pastāvīguma nodrošināšanā.
Dendrītiskās šūnas un makrofāgi ir organisma aizsardzības šūnas, kas mīt zarnu gļotādā un ir pirmās, kas saskaras ar zarnās nonākušajiem antigēniem – pārtikas, baktēriju komponentiem, toksīniem utt. – un sāk imūnās atbildes īstenošanu. Šīs šūnas ar saviem izaugumiem uztver minētos antigēnus. Pēc saskares ar antigēnu tās “piegādā” uztvertā antigēna fragmentu T limfocītiem, tādējādi tos aktivējot. Zarnu mikrovide – uzturs un mikrobioms jeb zarnās esošo mikroorganismu kopums – būtiski ietekmē un maina T līdzētājšūnu diferenciāciju (T limfocītu fenotipu veidošanos) zarnās.
T līdzētājšūnu fenotipi
Aktivēti CD4+ limfocīti ir iedalāmi vairākos apakštipos jeb fenotipos. Ir atklāti Th 1, Th 2, Th 9, Th 17, Th 22, regulējošie T limfocīti (T reg) un folikulārie regulējošie (fT reg) limfocīti. Šie limfocītu fenotipi izstrādā atšķirīgus proteīnus: Th 9 galvenokārt izdala interleikīnu-9 (IL-9), Th 17 izdala interleikīnu-17 (IL-17), bet Th 22 – interleikīnu-22 (IL-22). Atšķiras arī limfocītu grupu imūnās funkcijas. Specifiski stimuli, proti, citokīni nosaka, kādu apakštipu un attiecīgi arī funkciju iegūs CD4+ limfocīti. Interleikīni ir citokīnu plašajai molekulu grupai piederoši proteīni. Piemēram, interleikīns-6 un interleikīns-23 izraisa Th 17 apakštipa limfocītu, interleikīns-12 – Th 1 apakštipa limfocītu, bet interleikīns-4 – Th 2 apakštipa veidošanos, bet transformējošais augšanas faktors β (TGFβ) sekmē T reg veidošanos.
Kopumā T līdzētājšūnu diferenciācija ir sarežģīts process, jo visām T līdzētājšūnām piemīt dinamisks plastiskums jeb spēja noteiktos apstākļos – noteiktu proteīnu un molekulāru mehānismu klātbūtnē – mainīt savu fenotipu un arī funkcijas.
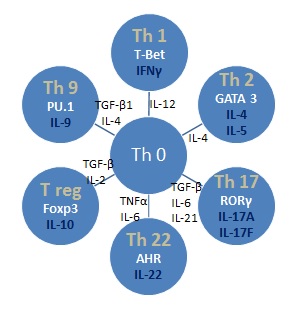
1. attēls. T līdzētājšūnu fenotipi un tos raksturojošie citokīni (autores veidots attēls)
1. attēlā parādīta T līdzētājšūnu fenotipu veidošanās no tā sauktā naivā – nepārveidotā T limfocīta (Th 0). Pie katra T limfocītu apakštipa (apļa) ar melnu krāsu norādīti to veidošanās ierosināšanai nepieciešamie citokīni. Aplī baltā krāsā norādīti fenotipa veidošanās ierosināšanai nepieciešamie transkripcijas faktori, bet zilā krāsā – to izdalītie citokīni.
20. gadsimta 80. gadu beigās tika atklāts, ka “naivās” T līdzētājšūnas (T limfocīti, kas vēl nav ieguvuši savu fenotipu) spēj diferencēties divos funkcionāli atšķirīgos apakštipos, un tā tika atklāti pirmie CD4+ T limfocītu apakštipi Th 1 un Th 2. Šāds iedalījums balstījās uz atšķirīgu citokīnu sekrēciju un imunoloģisko funkciju cīņā ar dažādiem patogēniem: Th 1 šūnas ražo citokīnu interferonu gamma (IFNγ), ir efektīvas cīņā pret šūnā iekļautiem jeb intracelulāriem patogēniem (intracelulāram patogēnam iekļūstot organismā, liela daļa no T līdzētājšūnām pārvērtīsies par Th 1 fenotipu) un piedalās šūnu mediētās un kavētā tipa hiperjutīguma reakcijās, izraisot iekaisuma ainu, kurā dominē monocīti. Savukārt Th 2 šūnas izdala IL-4 un IL-5 un darbojas pret parazītiem (helmintiem). Th 2 šūnas sekmē B limfocītu veidošanos un specifisku antivielu ražošanu, kā arī ir iesaistītas alerģiskās imūnās atbildēs, piemēram, astmas, atopiskā dermatīta attīstībā. Ar laiku tika noskaidrots, ka gan Th 1, gan Th 2 izdala arī citus citokīnus, piemēram, Th 1 šūnas izdala arī audzēju nekrozes faktoru alfa (TNFα), IL-2, IL-12, bet Th 2 – IL-10 un IL-13.
Th 9 fenotipu izraisa transformējošā augšanas faktora TGF-β1 un IL-4 vienlaikus klātbūtne. Th 9 šūnas izdala IL-9 un ir iesaistītas alerģiskās elpceļu, tostarp astmas, kā arī iekaisīgās ādas un zarnu reakcijās.
Th 22 ir T līdzētājšūnas, kas izdala IL-22 un aizsargā pret noteiktām baktērijām, piemēram, Klebsiella pneumoniae. Lai šīs šūnas veidotos, nepieciešami TNFα un IL-6 stimulējoša klātbūtne. Starp Th 22 un Th 17 pastāv noteikta mijiedarbība. IL-17 klātbūtnē IL-22 ir iekaisumu sekmējošs proteīns, bet, ja IL-17 nav iesaistīts, tad IL-22ir pretiekaisuma darbība. Pētījumos ir pierādīts, ka IL-22 nosaka psoriāzes attīstības gaitu – psoriāzes pacientiem ir paaugstināts IL-22 līmenis asinīs, kas korelē ar slimības smagumu.
Gan Th 22, gan Th 17 šūnām ir specifisks membrānas proteīns, hemokīnu receptors-6 (CCR-6), un šādas šūnas raksturīgas gremošanas un elpceļu sistēmu gļotādu virsmās. Th 22 šūnas mijiedarbībā ar Th 17 šūnām iesaistītas tādas autoimūnas slimības kā multiplā skleroze progresēšanā. Ir pierādīts, ka multiplās sklerozes pacientiem ir paaugstināts IL-22 līmenis asinīs, kā arī šo pacientu cerebrospinālajā šķidrumā atrod Th-17 šūnas.
T reg savukārt apdzīvo galvenokārt zarnas un nodrošina imūno toleranci. T reg izdala interleikīnu-10, kas ir iekaisumu mazinošs citokīns. Noteiktos apstākļos, piemēram, zarnu iekaisuma gadījumā, T reg spēj pārvērsties par Th 17 šūnām, kas sekmē autoimunitātes veidošanos.
Divu IL-17 izoformu IL-17A un IL-17F izstrādājošās Th 17 šūnas kā atsevišķs T līdzētājšūnu fenotips tika atklātas 21. gadsimta sākumā. Šodien Th 17 šūnas no citiem T līdzētājšūnu fenotipiem atšķir arī speciāls šo šūnu virsmas proteīns, un to sauc par CD161. Th 17 diferencējas no zarnu un elpceļu gļotādā mītošiem T limfocītiem citokīnu TGF-β, IL-6, IL-21 un citu kātbūtnē, savukārt citokīni IL-21, IL-23, IL-1β ir nepieciešami šī fenotipa uzturēšanai. Galvenie Th 17 bloķētāji jeb inhibitori ir IFNγ un IL-4, kas attiecīgi ir citokīni, kurus primāri ražo Th 1 un Th 2 šūnas. Th 17 šūnas izraisa iekaisumu ar neitrofilo leikocītu dominanti.
Bez IL-17A un IL-17F Th 17, kas ir neitrofilos leikocītus piesaistoši citokīni, Th 17 šūnas izdala arī citus iekaisumu stimulējošos citokīnus IL-21, IL-22, kā arī TNFα un GM-CSF (granulocītu makrofāgu koloniju stimulējošo faktoru). Pastāv uzskats, ka šīs ir vienas no sarežģītākajām T līdzētājšūnu populācijām. No vienas puses, šīs šūnas, kas apdzīvo galvenokārt gremošanas trakta un elpceļu gļotādu, kopā ar citām imūnās sistēmas šūnām, tādām kā makrofāgi un dendrītiskās šūnas, nodrošina organisma aizsardzību pret patogēniem, liekot zarnu epitēlijam ražot un izdalīt speciālus aizsargājošus proteīnus jeb defensīnus, kā arī sekmē audu dzīšanu. Zarnās Th 17 šūnas mīt arī zarnu epitēlijā un, izdalot IL-17A un IL-17F, pasargā gremošanas traktu no patogēniem.
Bet, no otras puses, šīs šūnas spēj sekmēt autoimūnu slimību attīstību, iedarbojoties uz šūnām, kas atrodas ārpus imūnās sistēmas (endotēlijs, epitēlijs), mudinot tās ražot proteīnus, kas sekmē iekaisuma šūnu, tādu kā, piemēram, neitrofilo leikocītu migrāciju, adhēziju. IL-17 ietekmē arī specifiskas saistaudus producējošas šūnas fibroblastus un rosina tos ražot proteīnus (metālproteāzes), kas uz organisma audiem iedarbojas degradējoši.
Lasītājs jau tika iepazīstināts ar šūnu plastiskuma jēdzienu. Th 17 šūnas demonstrē izteiktu plastiskumu un noteiktu stimulu klātbūtnē spēj pārtapt par jebkuru no T līdzētājšūnu fenotipiem, kā tas parādīts 2. attēlā.
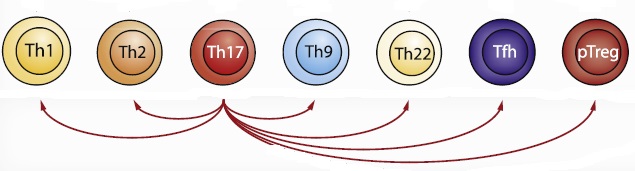
2. attēls. Th 17 šūnu plastiskuma shematisks attēlojums
Avots: Stadhouders R. et al. A cellular and molecular view of T helper 17 cell plasticity in autoimmunity.
2. attēlā izmantoti iepriekš rakstā neminēti saīsinājumi: Tfh – folikulārās T līdzētājšūnas, pTreg – perifērie regulējošie T limfocīti.
Īpaši pieminama ir Th 17 diferencēšanās IL-12 klātbūtnē par Th 1 (normā ražo IFNγ) ar Th 17 raksturīgo spēju izdalīt IL-17A. Šādas šūnas (Th 17/Th 1), kuras uzskata par īpaši patogēnām, atrodamas Krona slimības pacientu zarnās, sinoviālajā šķidrumā juvenilā idiopātiskā artrīta gadījumā, kā arī 1. tipa cukura diabēta un sistēmiskās sarkanās vilkēdes pacientiem. Līdz ar Th 17 šūnu atklāšanu un to izzināšanu būtiski ir mainījies uzskats par T līdzētājšūnu iesaisti autoimunitātes veidošanā. Sākotnēji uzskatīja, ka Th 1 fenotips izraisa autoimūnas saslimšanas, taču tagad tieši Th 17 šūnas uzskata par noteicošām autoimūno slimību patoģenēzē.
Jau tika minēts, ka IL-23 ir iekaisumu un autoimunitāti sekmējošs citokīns, kurš izraisa multiorgānu iekaisumu un kuru izdala dendrītiskās šūnas (galvenokārt zarnās) saskarsmē ar noteiktiem antigēniem. Tā, piemēram, Krona slimības un celiakijas pacientiem pastiprināti veidojas IL-23 receptori un šo pacientu zarnās atrod paaugstinātu IL-23 izdalīšanos. Arī sistēmiskās sarkanās vilkēdes pacientu asinīs konstatē paaugstinātu IL-23 koncentrāciju. Jo augstāks IL-23 līmenis, jo vairāk slimības attīstības procesā iesaistītas nieres. Reimatoīdā artrīta pacientu asins serumā un sinoviālajā šķidrumā ir paaugstināti ne tikai IL-23, bet arī IL-17. Ir novērots, ka minēto autoimūno slimību gadījumā pacientu perifērajās asinīs atrod ne tikai paaugstinātu IL-17 līmeni, kura līmenis asinīs kopumā korelē ar slimības norises smagumu, bet konstatē arī kvantitatīvu disbalansu starp Th 17 un T reg šūnām. Hašimoto slimības gadījumā Th 17 šūnu skaits korelē ar antitireoīdperoksidāzes imūnglobulīnu līmeni.
Ir būtiski pieminēt, ka IL-23 un IL-12 pārstāv vienu citokīnu ģimeni un tiem ir kopīga strukturālās uzbūves vienība p40. Monoklonālo antivielu preparāts ustekinumabs bloķē IL-12/23p40 un pasaulē efektīvi tiek lietots Th 17 šūnu nomākšanā un autoimūnu slimību ārstēšanā. Tomēr šie preparāti neārstē disregulētas imūnās sistēmas cēloni, kas nereti ir iekaisums zarnu gļotādā.
Mikrobioms un autoimunitāte
Cilvēka gremošanas trakts izceļas ar vislielāko virsmas laukumu (200 līdz 300 m2), kurā nepārtraukti notiek saskarsme ar antigēniem: gan no zarnu traktu apdzīvojošajām baktērijām, gan no uzturā uzņemtās pārtikas. Zarnās atrodas lielākā daļa cilvēka imūnās sistēmas un zarnu mikrobioms atrodas pastāvīgā komunikācijā ar zarnās esošajām imūnajām šūnām, un to starpā pastāv cieša, regulējoša mijiedarbība.
Galvenās zarnu baktēriju grupas ir Bacteroidetes un Firmicutes, un tās nodrošina normālu zarnu gļotādu, pasargā no patogēniem, “pielīpot” pie zarnu gļotādas. Tur tās izdala vielas, kuras pasargā no patogēniem, kā arī sekmē ciešos kontaktus starp epitēlijšūnām, nodrošinot zarnu gļotādas mehānisko integritāti. Zarnu mikrobioms arī ierosina zarnu gļotādu producēt imūnglobulīnu A, kas neļauj nevēlamajām baktērijām kolonizēties un iemitināties zarnu epitēlijā.
Zarnu mikrobioms producē neaizstājamās aminoskābes, vitamīnus (piemēram, K vitamīnu) un īso ķēžu taukskābes (acetātu, osovalerātu, propionātu, butirātu), kas ne tikai nodrošina enerģiju zarnu epitēlijšūnam un ir nozīmīgas ciešo kontaktu nodrošināšanā starp epitēlijšūnām, veidojot mehānisku barjeru patogēniem, bet sekmē T reg veidošanos un iekaisuma šūnu neitrofilo leikocītu būtisku samazināšanos. Zarnu mikrobioms palīdz arī sagremot un padarīt absorbējamas uzturvielas, kas citādi organismam nebūtu uzņemamas.
Zarnu baktērijas ir būtiskas T līdzētājšūnu diferenciācijā un plastiskuma regulācijā. Kā jau iepriekš uzsvērts, tieši plastiskumam ir nozīme imūnās tolerances un iekaisuma procesos. T naivās līdzētājšūnas atceļo no aizkrūts dziedzera kā nenobrieduši T limfocīti, pa asins ceļu nonāk līdz zarnām, nokļūst ar zarnu gļotādu saistītajos limfoīdajos audos (Peiera folikuli), kur mijiedarbībā ar antigēnprezentētājšūnām tiek aktivētas.
Zarnu mikrobioms, kā arī zarnu gļotādā esošā citokīnu vide, ko regulē zarnu mikrobioms, nosaka T līdzētājšūnu diferenciācijas ceļu. Savukārt zarnu mikrobiomu ir iespējams veidot, mazinot vai izslēdzot no uztura pārtikas produktu grupas, kas sekmē iekaisuma citokīnu produkciju. Tādas, piemēram, ir cukurs, “ātrie ogļhidrāti”, piena produkti, glutēnu saturoša pārtika. Ir pierādīts, ka, ja zarnās jau ir iekaisums, proteīnu – jo īpaši piena proteīnu – uzņemšana pastiprina iekaisuma ainu. Pat vēl vairāk – iekaisuma mikrovide ierosina patogēno Th 17 šūnu veidošanos.
Tieši Th 17 šūnām ir liela nozīme zarnu iekaisuma imūnajā modulācijā. No vienas puses, Th 17 ir iesaistītas zarnu gļotādas barjeras imunitātes nodrošināšanā un IgA sekrēcijas regulācijā (regulē gēna ekspresiju, kas nepieciešama, lai IgA varētu pārnest no zarnu barjeras uz zarnu lūmenu), bet, no otras puses, noteiktas citokīnu vides apstākļos Th 17 var kļūt par destruktīvu, autoimunitāti sekmējošu T līdzētājšūnu fenotipu, kas ir iesaistīts ne tikai iekaisuma sekmēšanā zarnās, bet arī ārpus tām.
Vairāki pētījumi liecina, ka autoimunitātes sākums ir tieši zarnās, kur ir izveidojusies tāda citokīnu vide, kas sekmē patogēno T līdzētājšūnu fenotipu veidošanos un izzūd IL-23/IL-17 regulācija. Nereti cilvēkiem ar autoimūnām slimībām ir novērota arī samazināta zarnu baktēriju daudzveidība.
Ar uzturu var modulēt IL-23 sekrēciju zarnās un mazināt un novērst patogēna Th 17 vai Th 17/Th 1 fenotipa veidošanos vai pat pavērst procesu pretējā virzienā – pārvērst to nepatogēnos fenotipos. Šāda modulācija sekmē patoloģisko procesu mazināšanos un veseļošanos. Dažas baktērijas, kas apdzīvo resno zarnu, piemēram, Bacteroides fragilis un daži Clostridia (pieder pie Firmicutes) serotipi, sekmē T reg veidošanos, kas mazina iekaisumu, izdalot IL-10. Arī pētījumi apstiprina, ka pacientiem ar iekaisīgo zarnu slimību ir samazināts Clostridia skaits. Savukārt gremošanas traktā galvenokārt tievās zarnas apakšējā daļā (ileum) mītoša īpaša baktēriju grupa, proti, segmentētās diegveida baktērijas (angļu val. segmented fillamentous bacteria), spēj ierosināt Th 17 šūnu fenotipa un autoimūnu procesu veidošanos.
Lai organismu pasargātu no imūnās sistēmas uzbrukuma paša organisma audiem, ir būtiski pārdomāt, ar kādu uzturu ikdienā organisms tiek barots. Arvien vairāk zinātniskos pētījumos tiek atzīts, ka uzturam ir ļoti būtiska nozīme organisma iekšējas vides līdzsvara un fizioloģisko funkciju nodrošināšanas un tātad veselības pamatā. Diemžēl ātro uzkodu (fast food) un ātro ogļhidrātu (makaroni, smalkmaizītes, picas, saldumi utt.) pārmērīga lietošana uzturā spēj izjaukt homeostāzi un smalko regulāciju, par ko bija runa raksta sākumā. Svarīgi atcerēties, ka mums vienmēr pastāv izvēles iespējas attiecībā uz to, ko mēs ēdam. Domājot par veselību, mēs varam izmantot un uztvert uzturu ne tikai kā barības vielas organisma šūnām, bet arī kā veselību veicinošu gēnu “ieslēgšanas” taktiku, kas pat organisma homeostāzes traucējumu – saslimšanu – gadījumā spēj organismā sekmēt līdzsvara un tātad – veselības atjaunošanos.
Atsauces
1. Abdel-Moneim, A. (2018) The potential pathogenic role of IL-17/Th17 cells in both type 1 and type 2 diabetes mellitus pieejams https://www.sciencedirect.com/science/article/abs/pii/S0753332217364995
2. Agalioti Th. et al. Th 17 cell plasticity: the role of dendritic cells and molecular mechanisms. Jounral of Autoimmunity 87 (2018). Pieejams https://reader.elsevier.com/reader/sd/pii/S0896841117307862?token=1900C67C75399998CC443E3E40C597342C338CB8E139C2B8502BD24EAE02F4D7CBECCFA45891C8228FA54C3099234DFF
3. Belkaid Y., Hand T. (2015) Role of the microbiota in immunity and inflammation. Pieejams https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4056765/
4. Blaschitz Ch., Raffatellu M. (2010) Th17 Cytokines and the Gut Mucosal Barrier. Pieejams https://link.springer.com/article/10.1007/s10875-010-9368-7
5. Chewning H. J., Weaver T. C. (2014) Development and Survival of Th17 Cells within the Intestines: The Influence of Microbiome- and Diet-Derived Signal. Pieejams http://www.jimmunol.org/content/193/10/4769
Costa S. V. et al. (2010) Unregulated IL 23/IL 17 immune response in autoimmune diseases. Diabetes Research and Clinical Practice. Pieejams https://www.diabetesresearchclinicalpractice.com/article/S0168-8227(10)00138-5/fulltext
6. Fard A. N. et al. (2016) The Potential Role of T Helper Cell 22 and IL-22 in Immunopathogenesis of Multiple Sclerosis. Pieejams https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5022987/
7. Malik S., Awasthi A. (2018) Transcriptional Control of Th9 Cells: Role of Foxo1 in Interleukin-9 Induction. Pieejams https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5954031/
8. Mosmann T. Th1 and Th2 cells: different patterns of lymphokine secretion lead to different functional properties. Pieejams https://www.annualreviews.org/doi/10.1146/annurev.iy.07.040189.001045
9. Solt, A. L. (2015) Th17 cells in Type 1 diabetes: a future perspective. Pieejams https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5046833/
10. Stadhouders, R. et al. A cellular and molecular view of T helper 17 cell plasticity in autoimmunity. Journal of Autoimmunity 87 (2018). Pieejams https://reader.elsevier.com/reader/sd/pii/S089684111730803X?token=6C0B2FA29FD18AB2A8D9E789C3C70F4871F4C8EB48B1183D400C689419C212B58C5E418E30497AEA5CCDA3D240CB72A5
11. Tabarkiewicz, J. et al. (2015) The Role of IL 17 and TH 17 lymphocytes in Autoimmune Diseases. DOI 10.1007/s00005-015-0344-z
12. Ueno, A. et al. (2018) Journal of Autoimmunity Th17 plasticity and its relevance to inflammatory bowel disease. Pieejams https://www.sciencedirect.com/science/article/pii/S0896841117307813?via%3Dihub
Foto: pexels.com
Rakstu lasiet arī „Ārsts.lv” 2019. gada marta numurā!
Portālā "Ārsts.lv" publicēto rakstu pārpublicēšana iespējama tikai, saskaņojot ar portāla redakciju!


