Diāna Lisova: Hronisks pankreatīts
Hronisks pankreatīts ir sindroms, kam raksturīgs aizkuņģa dziedzera hronisks iekaisums, fibroze un acināro šūnu zudums, kas var izpausties ar sāpēm vēderā, aizkuņģa dziedzera funkcijas – gremošanas fermentu un insulīna izdales – izmaiņām, uzturvielu uzsūkšanās traucējumiem un radioloģiskās vai endoskopiskās izmeklēšanas metodēs redzamu aizkuņģa dziedzera struktūras bojājumu.
Pirms 2016. gada hronisks pankreatīts tika definēts pēc klasiskās klīniski histoloģiskās pieejas – kā tipiskie tā simptomi, saistīti ar hronisku aizkuņģa dziedzera iekaisumu un neatgriezenisku fibrozi. Hroniska pankreatīta diagnostikas izaicinājums bija aizkuņģa dziedzera audu paraugu iegūšana, kas ir “zelta standarts” histoloģiskai diagnozei, īpaši izvērtējot biopsiju augsto risku/ieguvuma koeficientu.
Tomēr agrīns hronisks pankreatīts, stadija, kad mērķtiecīga terapija var būt visefektīvākā, nevar tikt diagnosticēts, izmantojot klīniski histoloģisko hroniska pankreatīta definīciju.
Aizkuņģa dziedzeris
Cilvēka orgāns – aizkuņģa dziedzeris ir dzeltenīgi pelēcīgs, graudains veidojums ar viegli daivainu struktūru, 15–20 cm garš un 75–110 g smags. Pirmoreiz tas tika atklāts 200 gadu pirms mūsu ēras un nodēvēts par “aknu pirkstu”. Galēns devis nosaukumu “aizkuņģa dziedzeris”. Savukārt 1642. gadā Virsungs atklājis aizkuņģa dziedzera izvadu cilvēkiem (Virsunga vads). 19. gs. tika atklāta aizkuņģa dziedzera eksokrīnā sekrēcija, radās nosaukums “fermenti”.
Tas ir jaukts eksokrīnās (ap 80% struktūras) un endokrīnās (ap 2% struktūras) sekrēcijas dziedzeris. Aizkuņģa dziedzera eksokrīnā daļa aizņem 80–90% no dziedzera kopējā tilpuma un ir iedalīta acinārajā un vadu sistēmā. Ap 20–40 acināro šūnu veido funkcionālo vienību, ko sauc par acinusu. Acinusa šūnas ir specializētas, lai sintezētu, uzkrātu un izdalītu gremošanas fermentus.
Cilvēka aizkuņģa dziedzeris saražo 1500–2500 ml aizkuņģa dziedzera sulas – bezkrāsaina šķidruma, kas ir bez smaržas un kura pH ir 8,0–8,3. Aizkuņģa dziedzera sula satur 1–3% olbaltumvielu, no kurām 90% ir gremošanas fermenti.
Aizkuņģa dziedzeris sekretē trīs galvenās gremošanas fermentu grupas:
- amilāzi – šķeļ ogļhidrātus. Amilāzi izdala arī siekalu dziedzeri; siekalu un aizkuņģa dziedzera amilāzei ir identiska fermentatīvā aktivitāte;
- lipāzi – šķeļ taukus;
- proteāzes (piemēram, tripsinogēns, elastāze) – šķeļ olbaltumvielas.
Hronisks pankreatīts var rasties pēc atkārtotām jebkuras etioloģijas akūta pankreatīta epizodēm. Akūts pankreatīts tiek uzskatīts par pārejošu notikumu, bet hronisks pankreatīts izraisa paliekošu aizkuņģa dziedzera bojājumu. Akūtu un hronisku pankreatītu vajadzētu uzskatīt par diviem vienas un tās pašas slimības posmiem, nevis atsevišķām slimībām.
Vairākas hroniska pankreatīta klīniskās izpausmes rodas pēc ilgāka laika un agrīnā fāzē var neizpausties. Hronisku pankreatītu ir viegli diagnosticēt, kad tiek novērotas tā vēlīnās fāzes klīniskās izpausmes, taču atklāt pareizo diagnozi agrīni, kad hroniska pankreatīta progresēšanas aizkavēšanas pasākumi var būt visefektīvākie, ārstam ir izaicinājums.
Etioloģija
Visbiežāk hronisku pankreatītu izraisa alkohols. Lai rastos hronisks pankreatīts, cilvēkam būtu jālieto aptuveni piecas alkohola vienības dienā vismaz piecus gadus ilgi. Interesanti, ka dažos pētījumos secināts – nelielām alkohola devām ir aizsargājoša ietekme uz aizkuņģa dziedzeri. Daudziem pacientiem agrīnā fāzē ir atkārtotas akūta pankreatīta epizodes, kam seko hroniska pankreatīta klīnisko simptomu aina: hroniskas sāpes vēderā, steatoreja un diabēts. Potenciālais hroniska pankreatīta sekmējošais faktors ir smēķēšana, kas ir neatkarīgs riska faktors tā attīstībai. Vairāk nekā 90% alkohola ģenēzes hroniska pankreatīta pacientu ir smēķētāji.
Smēķēšana izraisa ap 25% hroniska pankreatīta gadījumu, palielina aizkuņģa dziedzera kalcifikācijas, eksokrīnas un endokrīnas mazspējas, kā arī vēža attīstības risku. Turpretī smēķēšanas atmešana mazina hroniska pankreatīta progresijas risku.
Hipertrigliceridēmija – pirmreizējai akūta pankreatīta attīstībai nepieciešams > 1000 mg/dl triglicerīdu līmenis, atkārtotu epizodi var izraisīt zemāks (> 500 mg/dl) triglicerīdu līmenis asinīs.
Ģenētisks hronisks pankreatīts – dažiem pacientiem ir autosomāli dominantas (piemēram, katjoniskā tripsinogēna gēna PRSS1) vai recesīvas gēnu mutācijas, kas var ietekmēt hroniska pankreatīta attīstību no paaudzes paaudzē. Šajās ģimenēs novēro hroniska pankreatīta attīstību agrīnā vecumā un ir liels aizkuņģa dziedzera vēža risks, sevišķi smēķētājiem.
Autoimūns pankreatīts – 1. tips ir viena no slimībām, kas saistīta ar imūnglobulīnu G4 (IgG4). Šiem pacientiem bieži ir paaugstināts IgG4 līmenis asinīs un aizkuņģa dziedzera histoloģiskā izmeklēšanā atrod IgG4 pozitīvas plazmas šūnas, limfoplazmocitāra sklerozējoša pankreatīta ainu. Vairāk nekā 60% pacientu raksturīga citu orgānu iesaiste – piemēram, žultsceļu striktūras, retroperitoneāla fibroze, intersticiāls nefrīts. 2. tips – parasti skar tikai aizkuņģa dziedzeri, nav IgG4 šūnu infiltrācijas aizkuņģa dziedzerī un IgG4 paaugstinājuma asins plazmā. 2. tipa autoimūns pankreatīts var būt saistīts ar iekaisīgām zarnu slimībām (čūlaino kolītu, Krona slimību).
Obstruktīvs hronisks pankreatīts – aizkuņģa dziedzera galvenā vada hroniska obstrukcija ar vēzi, saaugumiem, akmeņiem, divpadsmitpirkstu zarnas sienas cistām u. c.
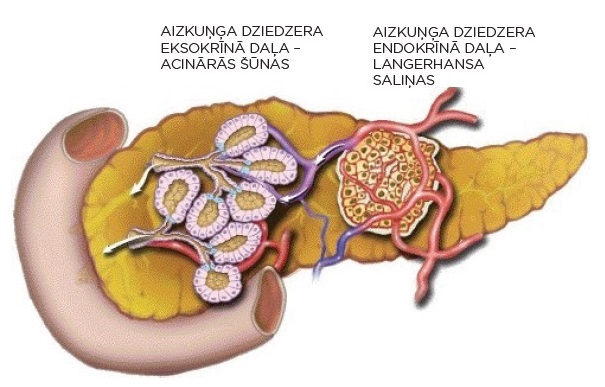
1. attēls. Aizkuņģa dziedzera eksokrīnā un endokrīnā daļa
Klīniskās izpausmes
Sāpes vēderā ir visbiežākais hroniska pankreatīta simptoms. Parasti sāpes lokalizējas pakrūtē un var izstarot jostas rajonā uz muguru. Sāpes var pastiprināties guļus vai pēc ēšanas. Visbiežāk sāpes rodas jauniem cilvēkiem alkohola vai smēķēšanas izraisīta un idiopātiska hroniska pankreatīta gadījumā.
Sāpju raksturs var atšķirties – dažiem pacientiem ir pastāvīgas dažādas intensitātes sāpes ar periodiskiem paasinājumiem, citiem – nepārtrauktas stipras sāpes. Daļai pacientu var būt sāpju epizodes ar ilgiem bezsāpju periodiem starp paasinājumiem. Šiem pacientiem hroniska pankreatīta paasinājumus var klasificēt kā atkārtotas akūta pankreatīta epizodes. Sāpju raksturs, laikam ritot, var mainīties, visbiežāk no epizodiskām uz pastāvīgām sāpēm. Tomēr sāpju rakstura maiņa vai pēkšņa pasliktināšanās liek meklēt pankreatīta komplikācijas – piemēram, pseidocistas, divpadsmitpirkstu zarnas vai žultsceļu obstrukciju vai sekundāru aizkuņģa dziedzera vēzi.
Sāpju smagums nekorelē ar izmeklējumos (piemēram, datortomogrāfiju vai magnētisko rezonansi, izmantojot holangiopankreatogrāfiju (MRHP)) diagnosticēto aizkuņģa dziedzera bojājuma smagumu. Pacientam var būt stipras sāpes, kaut gan datortomogrāfijas izmeklējumā redzamas nelielas izmaiņas aizkuņģa dziedzerī, vai arī kādu laiku sāpju var nebūt gadījumā, kad aizkuņģa dziedzerī jau notikušas dramatiskas izmaiņas. Sāpes ir biežākais iemesls hospitalizācijai, endoskopiskām vai ķirurģiskām intervencēm, tās visvairāk ietekmē cilvēka dzīves kvalitāti.
Sāpju iemesls hroniska pankreatīta pacientiem var būt paaugstināts spiediens aizkuņģa dziedzera izvadā, išēmija vai iekaisums aizkuņģa dziedzerī vai hroniska pankreatīta komplikācijas. Šie mehānismi var pārklāties. Nociceptīvo sāpju neironu bojājuma un centrālās nervu sistēmas (muguras smadzeņu) neirālo signālu reorganizācijas dēļ pacientam var rasties nepārejošas sāpes neatkarīgi no norisēm aizkuņģa dziedzerī. Šiem pacientiem rodas hiperalgēzija (stipras sāpes kā atbilde uz nelielu sāpju stimulu) vai allodīnija (sāpes kā atbilde uz stimuliem, kas nav patoloģiski). Šīs izmaiņas sāpju uztverē ļauj izskaidrot biežo pretsāpju terapijas neveiksmi, ja tā vērsta tikai uz aizkuņģa dziedzeri vai aizkuņģa dziedzera vadu.
Steatoreja – taukaina, smakojoša vēdera izeja, kas rodas tauku gremošanas traucējumu dēļ. Aizkuņģa dziedzera bojājumam jāskar ap 90% acināro šūnu (sk. 1. attēlu), pirms attīstās gremošanas traucējumi aizkuņģa dziedzera eksokrīnas mazspējas dēļ. Šāda apjoma bojājuma attīstība var aizņemt ilgu laiku.
Asimptomātiski – lai gan lielākajai daļai hroniska pankreatīta pacientu ir nozīmīgi klīniskie simptomi, nelielai daļai var nebūt sūdzību. Šiem cilvēkiem hronisku pankreatītu diagnosticē nejauši, piemēram, veicot datortomogrāfijas izmeklējumu citu iemeslu dēļ.
Laboratorā atrade – amilāzes un lipāzes līmenis asinīs pacientiem ar hronisku pankreatītu serumā bieži ir zems, tādēļ tam nav diagnostiskas nozīmes. Pacientiem ar akūtu pankreatītu epizodi amilāzes vai lipāzes līmenis serumā vismaz trīsreiz pārsniedz normas augšējo robežu. Tomēr pacientiem ar atkārtotām akūta pankreatīta epizodēm amilāzes un lipāzes paaugstinājumam ir tendence samazināties ar katru jaunu paasinājumu. Pacientiem ar pierādītu hronisku pankreatītu pat smagu paasinājumu gadījumā bieži novēro fermentu minimālu paaugstinājumu vai tā vispār nav. Šīs izmaiņas visdrīzāk ir saistītas ar acināro šūnu (fermentu producētāju) bojāeju aizkuņģa dziedzerī.
Bilirubīna un sārmainās fosfatāzes paaugstināšanos serumā var saistīt ar žultsvada intrapankreatiskās daļas kompresiju aizkuņģa dziedzera fibrozes vai tūskas dēļ. Dzelte vai nozīmīgi žults atteces traucējumi var rasties arī sekundāra aizkuņģa dziedzera vēža gadījumā.
Pacientiem ar hronisku pankreatītu rodas taukos šķīstošo vitamīnu, galvenokārt D vitamīna, deficīts, kas palielina metabolo kaulu slimību risku. Ūdenī šķīstošo vitamīnu un mikroelementu deficīts rodas retāk.
Ja hroniska pankreatīta iemesls ir hipertrigliceridēmija, serumā ir paaugstināts triglicerīdu līmenis.
Pacientiem ar 1. tipa autoimūnu pankreatītu paaugstinās IgG4 līmenis, kas ir diagnostikas kritērijs. Var būt paaugstināti arī citi autoimunitātes marķieri (ANA, SMA u. c.).
Gēnu analīzes veic atsevišķiem pacientiem, ja ir aizdomas par ģenētisku pankreatītu (neprecizētas, atkārtotas akūta pankreatīta epizodes bērnībā; idiopātisks hronisks pankreatīts pirms 40 gadu vecuma; zināmi radinieki ar autoimūnu pankreatītu).
Radioloģiskie izmeklējumi – agrīnās slimības stadijās var būt neinformatīvi.
- Vēdera pārskata rentgenogramma – redzami difūzi aizkuņģa dziedzera kalcināti.
- Vēdera dobuma ultrasonogrāfija – ierobežota hroniska pankreatīta diagnostiska iespēja (ap 60%) – aizkuņģa dziedzeri var neredzēt adipozitātes vai zarnu gāzu dēļ.
- Datortomogrāfijas izmeklējums – izmeklējot pēc aizkuņģa dziedzera protokola, “zelta standarts” hroniska pankreatīta diagnostikai (sk. 2. attēlu).
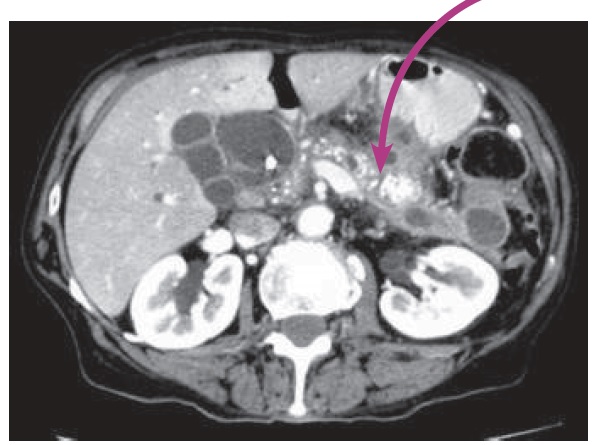
2. attēls. Datortomogrāfijas attēls, kurā redzami kalcināti aizkuņģa dziedzerī
- Magnētiskās rezonanses izmeklējums ar holangiopankreatogrāfiju (MRHP).
- Endoskopiskā ultrasonoskopija – detalizēta aizkuņģa dziedzera parenhīmas un izvada izmeklēšanas metode, kas tiek uzskatīta par papildu metodi. Hroniska pankreatīta diagnozi nenosaka tikai pēc endoskopiskās ultrasonoskopijas atrades (metodes jutība > 80%, savukārt specifiskums – ap 50%), to kombinē ar citu izmeklējumu datiem – piemēram, MRHP vai fēču elastāzes noteikšanu. Endoskopiskās ultrasonoskopijas laikā var veikt aizkuņģa dziedzera biopsiju, piemēram, autoimūna pankreatīta diagnostikai.
- Histoloģiska aizkuņģa dziedzera biopsiju materiāla izmeklēšana – tiek uzskatīta par “zelta standartu” augsta riska pacientiem, kam vizuālās diagnostikas metodes nedod pietiekamu informāciju diagnozes apstiprināšanai.
Aizkuņģa dziedzera tiešie funkcionālie testi – eksokrīno funkciju var noteikt, ievadot aizkuņģa dziedzeri stimulējošos hormonus (holecistokinīnu, sekretīnu) un savācot aizkuņģa dziedzera izdalīto sulu no duodena ar duodenālu zondi vai duodenoskopu. Holecistokinīnu izmanto acināro šūnu funkcijas noteikšanai agrīna hroniska pankreatīta diagnostikai. Ar sekretīna testu nosaka aizkuņģa dziedzera vadiņu šūnu funkciju. Šādus testus veic tikai specializētos centros un ikdienas klīniskajā praksē neizmanto.
Aizkuņģa dziedzera netiešie funkcionālie testi
- Kvantitatīva 72 stundu fēču tauku daudzuma noteikšana – izmanto pētījumu nolūkos.
- Aizkuņģa dziedzera fermenta elastāzes noteikšana fēcēs: plaši pieejams, viegli izpildāms, neinvazīvs tests. Elasāzes līmenis < 100 mcg/g norāda uz aizkuņģa dziedzera eksokrīnu mazspēju, savukārt, ja līmenis > 100, bet < 200 mcg/g, nepieciešami papildizmeklējumi diagnozes apstiprināšanai.
- C-13 triglicerīdu elptests – testa jutība – 90%, taču tas ir laikietilpīgs (aizņem 4–6 stundas).
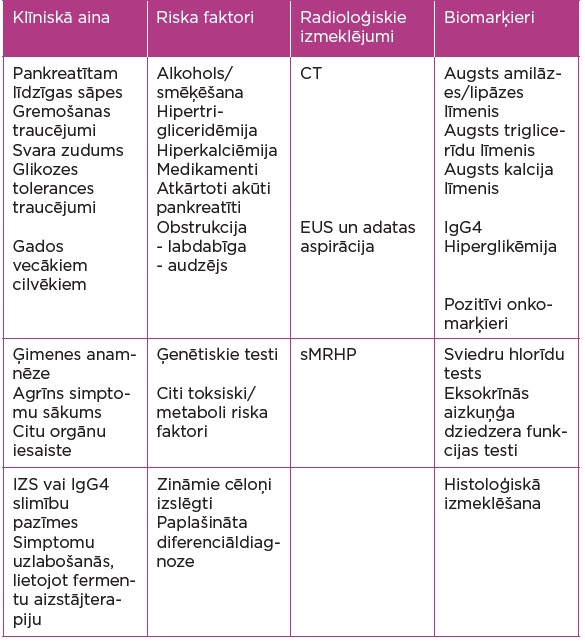
1. tabula. Aizdomas par hronisku pankreatītu
CT – datortomogrāfija, EUS – endoskopiskā ultrasonogrāfija, sMRHP – magnētiskās rezonanses holangiopankreatogrāfija ar sekretīna stimulācijas testu, IZS – iekaisīga zarnu slimība, IgG4 – imūnglobulīns G4.
Hroniska pankreatīta komplikācijas
Pseidocistas – rodas ap 10% hroniska pankreatīta slimnieku. Tās ir šķidruma krātuves ar sieniņām, ko veido granulācijas audi, saskatāmas ultrasonoskopijas, datortomogrāfijas vai magnētiskās rezonanses izmeklējumā. Lielākā daļa pseidocistu ir saistītas ar aizkuņģa dziedzera vadu sistēmu un augstā koncentrācijā satur gremošanas fermentus.
Daļa pseidocistu ir asimptomātiskas, bet var izraisīt sāpes vēderā, svara zudumu un dzelti, jo ir aizsprostoti kuņģa, zarnu vai žults ceļi. Pseidocistas parasti ir sterilas, bet ap 10% var inficēties – parasti ar zarnu floru. Infekcijas pazīmes ir drudzis, hipotensija, leikocitoze. Ja infekciju neārstē, tā var progresēt peritonītā, sepsē.
Diferenciāldiagnstika: cistiskas neoplazmas, aizkuņģa vēža cistiska deģenerācija, retences cistas.
Terapija: asimptomātiskas pseidocistas nav jāārstē. Terapija atkarīga no simptomiem, šķidruma kolekcijas lokalizācijas un raksturojuma, komplikāciju (pseidoaneirismas, infekcija) attīstības.
Pankreatisks ascīts/šķidrums pleiras telpā – ap 10% pacientu var rasties pēc aizkuņģa dziedzera vada bojājuma vai pseidocistas ruptūras, kā dēļ aizkuņģa dziedzera sula nokļūst vēdera dobumā vai pleiras telpā.
Pacienti ar pankreatisku ascītu var būt asimptomātiski, taču visbiežākie simptomi ir sāpes vēderā, krūtīs un aizdusa.
Diagnozi precizē, veicot pleiras telpas vai ascīta punkciju un lipāzes noteikšanu šķidrumā.
Terapija: aizkuņģa dziedzera fistulas terapijai – oktreotīds (ilgstošas darbības somatostatīna analogs); endoskopiska stenta ievade vai ķirurģiska ārstēšana.
Duodena vai žultsvadu obstrukcija – 5–10% pacientu rodas aizkuņģa dziedzera galviņas iekaisuma un fibrozes vai tieša pseidocistas izraisīta žultsvadu saspieduma dēļ.
Žultsceļu obstrukcija izraisa sāpes pakrūtē, sliktu dūšu, dzelti. Ilgstošs žultsceļu nospiedums izraisa žultsceļu iekaisumu (holangītu), veicina biliāras cirozes rašanos.
Divpadsmitpirkstu zarnas nospiedums rodas aizkuņģa dziedzera un apkārtējo audu fibrozes dēļ, kas bieži saistīta ar žultsceļu obstrukciju un iekaisumu aizkuņģa dziedzera galviņā. Kā risinājums var būt pankreatoduodenāla rezekcija (Whipple operācija) vai duodenu saudzējoša aizkuņģa dziedzera galviņas rezekcija.
Asinsvadu komplikācijas:
- pseidoaneirismas – reta komplikācija, visbiežāk iesaistīta liesas artērija, gastroduodenālā vai pankreatoduodenālās artērijas. Diagnozi apstiprina, izmantojot mezenteriālo angiogrāfiju;
- liesas vēnas tromboze un kuņģa varikoze – vairāk nekā 12% pacientu liesas vēnas tromboze rodas hroniska pankreatīta dēļ (liesas vēna iet gar aizkuņģa dziedzera mugurējo virsmu). Šiem pacientiem kreisās puses portālas hipertensijas dēļ rodas varikozi paplašinātas vēnas kuņģī (bez barības vada vēnu varikozes). Simptomātiskiem pacientiem var sākties varikoza asiņošana.
Hroniska pankreatīta terapija
Tā kā vēlīns hronisks pankreatīts ir neatgriezeniska slimība, galvenie terapijas mērķi ir sāpju kontrole un slimības komplikāciju ārstēšana.
- Hroniska pankreatīta pacientiem neatkarīgi no pankreatīta etioloģijas jāatturas no alkohola lietošanas.
- Rekomendē atmest smēķēšanu.
- Medikamentoza terapija
- Pretsāpju terapija: pakāpeniska pieeja (nesteroīdie pretiekaisuma līdzekļi, paracetamols). Pretsāpju terapijas principi ir līdzīgi jebkuru hronisku sāpju terapijai. Opiātus rekomendē tiem pacientiem, kuriem citas terapijas iespējas ir izsmeltas.
- Antidepresanti – depresijas ārstēšanai, pretsāpju līdzekļu potencēšanai.
- Rekomendē saules pinuma (plexus coeliacus) blokādi. Tā ir medikamenta (lokālās anestēzijas un steroīda, piemēram, bupivakaīna un triamcinolona, kombinācija) injekcija plexus coeliacus. Blokādi var veikt endoskopijas, invazīvās radioloģijas vai ķirurģiskās iejaukšanās ceļā. Blokādes plusi ir potenciālā sāpju mazināšana uz 3–6 mēnešiem; procedūru var atkārtot. Blokādes mīnusi ir ar procedūru saistītie riski – asiņošana.
- Aizkuņģa dziedzera eksokrīnās mazspējas gadījumā – aizkuņģa dziedzera fermentu aizstājterapija (ADzFT). Tā nemazina sāpes hroniska pankreatīta pacientiem.
- ADzFT jālieto katrā ēdienreizē, kas satur taukus, 40 000–50 000 DV ēdienreizē un 20 000–25 000 DV uzkodās. Preparāti jālieto ēdienreizes sākumā, kapsulas jānorij veselas – nedrīkst sakošļāt! Ja terapijai nav efekta, palielina fermentu preparāta devu – 2000–4000 DV uz katru vienu uzņemto tauku gramu. Pievieno kuņģa skābi mazinošu terapiju (protonu sūkņu inhibitorus).
- HP pacientiem jāizvērtē malabsorbcijas riski – tostarp osteoporozes skrīnings, taukos šķīstošo vitamīnu deficīta korekcija.
- Autoimūna pankreatīta pacientiem nepieciešama steroīdu terapija, imūnmodulatori.
- Pacientiem, kas aktīvi lieto alkoholu, agresīvu endoskopisku vai ķirurģisku iejaukšanos rekomendē ar piesardzību. Alkohola lietošana var izraisīt vai pastiprināt tās sāpes, kuru ārstēšanai plānotas šīs endoskopiskās vai ķirurģiskās procedūras. Pārtraucot alkohola lietošanu, šīs procedūras var nebūt vajadzīgas.
- Endoskopiska ārstēšana – izmanto aizkuņģa dziedzera vada striktūru, akmeņu, pseidocistu, biliāru striktūru, duodena kompresijas vai aizkuņģa dziedzera audzēja gadījumos.
- Endoskopiskas atslogojošas procedūras ir ERHP (endoskopiskā retrogrādā holangiopankreatogrāfija) ar aizkuņģa dziedzera sfinkterotomiju, akmeņu evakuāciju, striktūru pārdalīšanu, stenta ievadīšanu. Citas endoskopiskas terapijas iespējas ir endoskopiskā urtrasonoskopija ar stenta ievietošanu aizkuņģa dziedzera vadā.
- Ķirurģiska ārstēšana
- Pacientiem ar obstruktīvu hronisku pankreatītu ilgtermiņa sāpju mazināšanai rekomendē ķirurģisku ārstēšanu gadījumā, ja endoskopiska terapija ir mazefektīva. Ir vairākas ķirurģiskas atslogojošas procedūras (piemēram, Frey, Berger procedūras). Pacientiem ar hronisku pankreatītu un žultsvada stenozi indicēta operācija – holedohoduodenostomija vai Roux-en-Y anastomoze. Pacientiem, kam žultsvadu obstrukcija saistīta ar stiprām sāpēm vēderā un izteiktu aizkuņģa dziedzera galviņas fibrozi, var būt indicēta aizkuņģa dziedzera galviņas rezekcija. Endoskopiska stenta ievade atslogošanai ir īslaicīgs risinājums.
- Pacientiem, kam žultsceļu obstrukcija saistīta ar aizkuņģa dziedzera galviņas pseidocistu, obstrukcijas mazināšanai var pietikt ar pseidocistas drenāžu.
- Hroniska pankreatīta pacientiem ar asinsvadu komplikācijām un asiņošanu veic pseidoaneirismas embolizāciju. Ja asiņošana turpinās un ir masīva, veic pankreatoduodenektomiju un asinsvada liģēšanu.
- Totāla pankreatektomija rekomendējama tikai atsevišķiem pacientiem ar refraktāru hronisku sāpju sindromu, ja citas metodes ir izsmeltas.
Foto: Shutterstock
Rakstu lasiet arī „Ārsts.lv” 2021. gada aprīļa numurā!
Portālā "Ārsts.lv" publicēto rakstu pārpublicēšana iespējama tikai, saskaņojot ar portāla redakciju!